Trong bài viết này, chúng ta hãy cũng tìm hiểu về tính chất của Axit sunfuric và các dạng tồn tại của nó.
H2SO4 là axit vô cơ phổ biến nhất hiện nay. Nó được tạo thành từ nguyên tố lưu huỳnh (S), oxy (O) và hydro (H). Công thức hóa học của loại Axit này là H2SO4. Tên trong Tiếng Anh của H2SO4 là Acid Sulfuric. Loại Axit này còn được biết đến dưới tên gọi dầu Sulfate và Hydro sulfate.
Tính chất vật lý của axit sunfuric H2SO4
- Axit sunfuric là chất lỏng, hơi nhớt và nặng hơn nước, khó bay hơi và tan vô hạn trong nước.
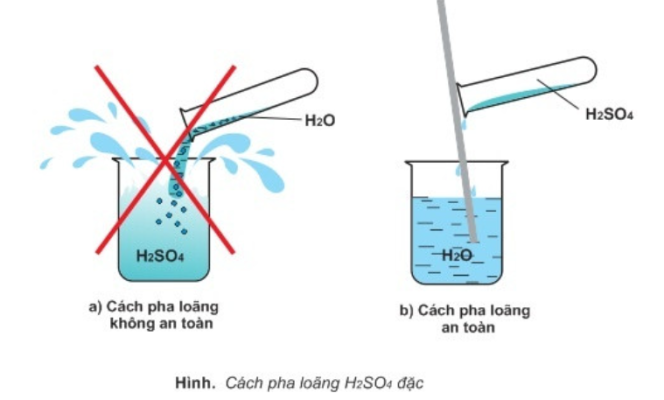
- Axit sunfuric đặc thường hút mạnh nước và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại, vì H2SO4 có thể gây bỏng.
- Axit sunfuric còn có khả năng làm than hóa các hợp chất hữu cơ.
Tính chất hóa học của H2SO4
H2SO4 có tính axit rất mạnh, tính bào mòn của loại Axit này cũng rất đáng kể. Axit Sunfuric có thể gây nguy hiểm cho bất kỳ thứ gì chạm vào nó nếu đủ nồng độ nhất định.
Axit Sunfuric có độ biến động tương đối thấp nên giữ vai trò quan trọng trong việc điều chế các loại Acid dễ bay hơi. Do đặc tính háo nước của mình, H2SO4 còn được sử dụng để làm khô nhiều loại khí không phản ứng với axit.
Tính Axit của H2SO4 có thể làm quỳ tím hóa đỏ.
Axit Sunfuric tồn tại dưới hai loại: axit đặc và axit loãng.
Tính chất hóa học của H2SO4 đặc
Trong H2SO4, nguyên tố lưu huỳnh có mức oxi hóa +6 là cao nhất của nguyên tố này. Dẫn đến, H2SO4 đặc có tính axit mạnh, tính oxi hóa và háo nước mạnh.
Do tính Axit mạnh của mình nên H2SO4 tác dụng được với hầu như tất cả kim loại ( trừ Au và Pt). Axit Sunfuric đặc, nóng tác dụng với Kim loại tạo thành muối kim loại có hóa trị cao, nước và SO2 (H2S,S).
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
Tính chất hóa học của axit sunfuric H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
Các dạng của axit sunfuric (H2SO4)
Tùy theo mục đích sử dụng mà H2SO4 tồn tại ở nhiều dạng khác nhau:
- H2SO4 loãng được sử dụng trong phòng thí nghiệm chỉ là 10%.
- Axit Sunfuric được sử dụng cho bình ắc quy có nồng độ ở khoảng 33,5%.
- Hàm lượng 62,18% thường được dùng để sản xuất phân bón.
- Trong tháp sản xuất hay axit glover, hàm lượng H2SO4 được sử dụng là 77,67%.
- Axit Sunfuric đậm đặc có nồng độ là 98%
Tại Hóa Chất Phú Tài, chúng tôi cung cấp tất cả các loại H2SO4 mà quý khách hàng có nhu cầu tìm mua. Phổ biến nhất là các loại H2SO4 30%, 50% và 98% với quy cách phi/ can/ bồn hợp quy chuẩn, xuất xứ từ Việt Nam.
Hãy liên hệ với chúng tôi để được tư vấn tận tình và nhanh chóng!